مقدمه
شخصیسازی درمان با rTMS بهعنوان رویکردی نوین در نورومدولاسیون، با هدف افزایش اثربخشی و کاهش عوارض جانبی، در سالهای اخیر مورد توجه قرار گرفته است. در این روش، پارامترهای درمانی مانند نوع کویل، محل تحریک، شدت پالسها، فرکانس و تعداد جلسات بر اساس ویژگیهای فردی بیمار – از جمله سن، ساختار مغز و نقشههای مغزی (qEEG) – تنظیم میشوند تا پاسخ درمانی بهینه حاصل شود.
کلمات کلیدی (Keywords):
rTMS، تحریک مغناطیسی مکرر، شخصیسازی درمان، آستانه تحریک حرکتی، نقشه مغزی، qEEG، فرکانس تحریک، پروتکل تتابرست، کویل TMS، نورونویگیشن
-
rTMS چیست؟
بهترین کلینیک TMS تهران -
تعریف و اصول عملکرد تحریک مغناطیسی مکرر
-
مکانیسم اثر بر نورونهای مغزی
-
کاربردهای درمانی در اختلالات روانپزشکی و نورولوژیکی
-
-
آشنایی با انواع کویلهای TMS
انواع کویل TMS -
کویل شکل ۸ (Figure-8 Coil)
-
کویل گرد (Circular Coil)
-
کویل H و کاربرد آن در dTMS
-
تأثیر شکل و نوع کویل بر عمق و دقت تحریک
-
-
آناتومی مغز و تأثیر آن بر قرارگیری کویل برای شخصیسازی درمان با rTMS
-
تفاوتهای فردی در ساختار جمجمه و مغز
-
تعیین محل دقیق تحریک بر اساس ویژگیهای آناتومیکی
-
استفاده از تصویربرداری MRI و روش Neuronavigation
-
-
تأثیر سن افراد بر تنظیم شدت تحریک
-
تغییرات سن و هدایتپذیری قشر مغز
-
تنظیم شدت پالسها بر اساس سن و ویژگیهای فیزیولوژیکی
-
ملاحظات ویژه برای سالمندان و نوجوانان
-
-
استفاده از نقشههای مغزی (qEEG) برای شخصیسازی پروتکل TMS
-
تحلیل نقشههای EEG برای شناسایی نواحی هدف
-
بررسی الگوهای بیشفعالی یا کاهش فعالیت در نواحی مغزی
-
طراحی پروتکل بر اساس یافتههای نوروفیزیولوژیکی فردی
-
-
پروتکلهای شخصیسازیشده تتا برست (Theta Burst Stimulation)
-
مزایای تتا برست در کاهش زمان درمان
-
تنظیم پارامترها بر اساس پاسخ مغزی و بالینی بیمار
-
تعیین تعداد جلسات درمانی TMS بر اساس پاسخ فردی
-
پروتکلهای استاندارد و متغیر
-
پایش پیشرفت بالینی و تنظیم تعداد جلسات
-
مفهوم «Maintenance Sessions» در جلوگیری از عود
-
-
انتخاب فرکانس مناسب برای درمان
-
فرکانسهای بالا (≥10Hz) در مقابل فرکانسهای پایین (≤1Hz)
-
انتخاب بر اساس نوع اختلال (افسردگی، اضطراب، PTSD و…)
-
بررسی پاسخپذیری به تحریک بر اساس فرکانسهای مختلف
-
-
یافتن آستانه تحریک حرکتی (Motor Threshold) و نقش آن در درمان
-
روشهای تعیین آستانه تحریک حرکتی (RMT / AMT)
-
کاربرد آستانه در تنظیم شدت تحریک در جلسات درمانی
-
رابطه بین آستانه تحریک و پاسخ درمانی
-
1. rTMS چیست؟
الف- تعریف و اصول عملکرد تحریک مغناطیسی مکرر (rTMS)
تحریک مغناطیسی مکرر مغز (repetitive Transcranial Magnetic Stimulation – rTMS) یک روش درمانی غیرتهاجمی و بدون درد است که برای تنظیم فعالیت مغز در بیماران مبتلا به اختلالات روانپزشکی و نورولوژیکی به کار میرود. در این روش، از یک کویل مغناطیسی استفاده میشود که روی پوست سر، در نزدیکی نواحی خاصی از قشر مغز قرار میگیرد. با عبور جریان الکتریکی از این کویل، میدان مغناطیسی پالسی و گذرایی ایجاد میشود که بدون عبور از پوست یا جمجمه، به مغز نفوذ کرده و باعث تحریک یا مهار فعالیت نورونی میگردد.
در rTMS، برخلاف تحریک مغناطیسی تکپالسی (single-pulse TMS)، از پالسهای متوالی و تکرارشونده استفاده میشود که بهصورت قطارهای پالس (pulse trains) ارسال میشوند و اثرات نوروفیزیولوژیکی پایدارتر و درمانی ایجاد میکنند. این تکرارها ممکن است در فرکانسهای بالا یا پایین اعمال شوند که هریک اثرات خاصی دارند.
ب- مکانیسم اثر بر نورونهای مغزی
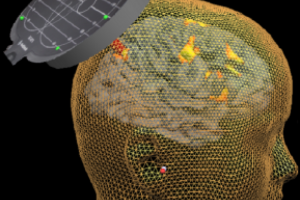
میدان مغناطیسی تولیدشده توسط کویل، با گذر از بافتهای سر، در قشر مغز باعث القای جریان الکتریکی ثانویه میشود. این جریان، اگر به اندازه کافی قوی باشد، میتواند دپولاریزاسیون نورونی ایجاد کند؛ یعنی آستانه تحریک سلولهای عصبی را رد کرده و موجب شلیک پتانسیلهای عمل شود. بسته به ناحیه تحریک، جهت جریان، شدت پالسها، و فرکانس آنها، rTMS میتواند:
-
فعالیت نورونی را افزایش دهد (در فرکانسهای بالا مانند 10 یا 20 هرتز)
-
یا فعالیت نورونی را کاهش دهد (در فرکانسهای پایین مانند 1 هرتز یا با استفاده از cTBS)
از نظر فیزیولوژیکی، این تحریکها میتوانند منجر به:
-
تغییر در پلاستیسیته سیناپسی (از طریق LTP یا LTD)
-
تنظیم سیستمهای نوروترنسمیتر مانند سروتونین، دوپامین و GABA
-
تعدیل عملکرد شبکههای مغزی مانند شبکه حالت پیشفرض (DMN)، شبکه اجرایی و شبکه توجه
ج- کاربردهای درمانی در اختلالات روانپزشکی و نورولوژیکی
rTMS در حال حاضر برای درمان طیفی از اختلالات مورد استفاده قرار میگیرد. برخی از مهمترین کاربردهای تأییدشده و پژوهشی آن عبارتاند از:
✅ افسردگی اساسی (Major Depressive Disorder – MDD)

مهمترین و گستردهترین کاربرد rTMS در درمان افسردگی مقاوم به درمان است. تحریک ناحیه DLPFC چپ (قشر پیشپیشانی پشتی جانبی) با فرکانس بالا در این بیماران اثربخشی بالایی داشته است.
✅ وسواس فکری-عملی (Obsessive-Compulsive Disorder – OCD)

تحریک ناحیه قشر پیشپیشانی یا مکمل حرکتی (SMA) در بیماران مبتلا به OCD به کاهش علائم کمک میکند.

درمانهای مبتنی بر rTMS برای کاهش دفعات و شدت حملات میگرنی استفاده شدهاند و در برخی موارد مورد تأیید FDA قرار گرفتهاند.
✅ توانبخشی نورولوژیکی
مانند بهبود حرکت اندامها پس از سکته مغزی با تحریک نواحی حرکتی یا بهبود زبان در آفازی.
✅ اختلالات دیگر در حال بررسی:
-
اسکیزوفرنی (برای علائم منفی یا توهمات شنیداری)
-
اختلالات اضطرابی
-

ترک سیگار با تی ام اس
2. آشنایی با انواع کویلهای TMS
کویل (Coil) بخش کلیدی در سیستم TMS است که میدان مغناطیسی را تولید میکند. شکل، اندازه و نوع کویل، نقشی تعیینکننده در عمق نفوذ تحریک، تمرکز میدان، و دقت تحریک ناحیه مغزی دارد. در ادامه به معرفی مهمترین انواع کویلهای مورد استفاده در TMS میپردازیم:
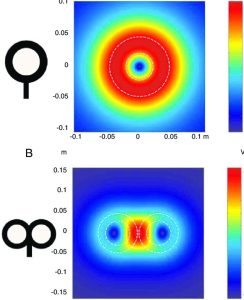
الف) کویل شکل ۸ (Figure-8 Coil)
این نوع کویل که به آن “Butterfly Coil” نیز گفته میشود، از دو حلقه سیم در کنار یکدیگر تشکیل شده است که جریان الکتریکی در جهت مخالف در آنها جریان دارد. تقاطع میدانهای مغناطیسی حاصل از دو حلقه، باعث تمرکز میدان در نقطهی مرکزی (جایی که دو حلقه به هم میرسند) میشود.
ویژگیها:
-
تمرکز بالا: نقطه تحریک بسیار دقیق و موضعی است.
-
عمق نفوذ متوسط: معمولاً تا عمق ۱.۵ تا ۲ سانتیمتر در قشر مغز.
-
مناسب برای تحریک نواحی سطحی قشر مغز مثل DLPFC یا M1.
-
رایجترین نوع کویل در مطالعات کلینیکی و پژوهشی rTMS.
ب) کویل گرد (Circular Coil)
کویل گرد از یک حلقه منفرد تشکیل شده است که میدان مغناطیسی را به صورت شعاعی (Radial) پخش میکند. برخلاف کویل شکل ۸، میدان تولیدشده در این کویل گستردهتر و کمتمرکزتر است.
ویژگیها:
-
پراکندگی میدان بیشتر: تحریک در ناحیهای وسیعتر صورت میگیرد، اما دقت موضعی کمتری دارد.
-
معمولاً در مطالعات اولیهی TMS یا برای تحریک نواحی کمتر حساس استفاده میشود.
-
کاربرد محدود در درمانهای دقیق مانند افسردگی، چرا که تمرکز پایین دارد.
ج) کویل H و کاربرد آن در dTMS
کویلهای H شکل (H-coil) در سیستمهای dTMS (deep TMS) مورد استفاده قرار میگیرند. این کویلها طراحی پیچیدهتری دارند و شامل چند حلقه در موقعیتهای مختلف هستند که بهگونهای تنظیم شدهاند تا بتوانند میدان مغناطیسی را به عمق بیشتری از مغز هدایت کنند.
ویژگیها:
-
عمق تحریک بیشتر: تا حدود ۴ الی ۵ سانتیمتر (در مقایسه با کویل شکل ۸)
-
امکان تحریک ساختارهای زیرقشری مانند cingulate cortex یا insula
-
بهدلیل عدم تمرکز دقیق، ممکن است تحریک نواحی ناخواسته نیز رخ دهد.
د) تأثیر شکل و نوع کویل بر دقت و عمق تحریک
نوع کویل انتخابشده نقش تعیینکنندهای در نحوهی هدفگیری نورونی دارد:
| نوع کویل | تمرکز میدان | عمق تحریک | دقت هدفگیری | کاربرد رایج |
|---|---|---|---|---|
| Figure-8 | بالا | متوسط | بسیار دقیق | افسردگی، rTMS استاندارد |
| Circular | کم | کم تا متوسط | پایین | مطالعات ابتدایی یا عمومی |
| H-coil (dTMS) | متوسط | زیاد | متوسط | افسردگی مقاوم، OCD |
نکته کلینیکی:
در انتخاب کویل باید بین دو معیار «تمرکز دقیق» و «دسترسی به عمق بیشتر» تعادل برقرار کرد. برای درمانهای استاندارد با هدف تحریک نواحی سطحی مانند قشر پیشپیشانی، کویل شکل ۸ انتخاب اول است؛ ولی در مواردی که تحریک ساختارهای عمقیتر مورد نظر باشد، کویل H در dTMS اولویت دارد.
3. آناتومی مغز و تأثیر آن بر قرارگیری کویل TMS
تفاوتهای فردی در ساختار جمجمه و مغز
یکی از چالشهای اصلی در درمان با rTMS، تفاوتهای بینفردی در ساختار آناتومیکی مغز و جمجمه است. این تفاوتها میتوانند در موارد زیر مشاهده شوند:
-
ضخامت جمجمه و پوست سر: میزان جذب و تضعیف میدان مغناطیسی
-
عمق ناحیه هدف از سطح جمجمه: ناحیهی قشر پیشپیشانی در برخی افراد ممکن است عمیقتر یا کمعمقتر باشد.
-
موقعیت آناتومیکی نواحی عملکردی: مانند DLPFC یا M1 که در افراد مختلف کمی جابهجا هستند.
-
شکل و زاویهی چینخوردگیهای مغز (Gyri & Sulci): که میتواند جهت جریان القایی و اثر آن را تغییر دهد.
همین عوامل باعث میشود که استفاده از روشهای استاندارد مانند «5 سانتیمتر جلوتر از ناحیه حرکتی» برای همهی بیماران دقیق و مؤثر نباشد.
تعیین محل دقیق تحریک بر اساس ویژگیهای آناتومیکی
برای افزایش دقت تحریک و بهبود نتایج درمانی، محل قرارگیری کویل باید بر اساس ویژگیهای آناتومیکی هر فرد بهصورت اختصاصی تنظیم شود. دو رویکرد کلی وجود دارد:
-
روشهای سنتی (Scalp-based Methods):
شامل اندازهگیری دستی فاصلهها بر اساس نقاط مشخص روی پوست سر مانند 10-20 EEG system یا روش 5-سانتیمتری از نقطهی موتور. این روشها ساده و بدون نیاز به تجهیزات پیشرفته هستند، اما دقت آنها برای همهی بیماران یکسان نیست. -
روشهای تصویرمبنـا (Image-guided):
بر اساس تصویربرداری مغزی مانند MRI ساختاری، محل دقیق ناحیه هدف شناسایی شده و کویل مستقیماً روی همان نقطه تنظیم میشود. این روشها بیشترین دقت را دارند و در درمانهای شخصیسازیشده کاربردیاند.
استفاده از تصویربرداری MRI و روش Neuronavigation
سیستمهای Neuronavigation ابزارهایی پیشرفته هستند که با بهرهگیری از تصاویر MRI فردی و سنسورهای موقعیتیاب، امکان هدفگیری دقیق ناحیه مغزی مورد نظر در زمان واقعی و شخصیسازی درمان با rTMS را فراهم میکنند.
مراحل کار بهطور خلاصه:
-
تصویربرداری MRI از مغز بیمار انجام میشود.
-
تصویر وارد نرمافزار Neuronavigation میگردد.
-
محلهای عملکردی مانند DLPFC، M1 یا SMA روی MRI مشخص میشوند.
-
با قرار دادن سنسورها روی سر بیمار و کویل، موقعیت و زاویه کویل در زمان واقعی با تصویر مغزی انطباق داده میشود.
-
درمان با دقت میلیمتری آغاز میشود.
مزایای Neuronavigation:
-
افزایش دقت تحریک و اثربخشی درمان
-
کاهش تحریک نواحی ناخواسته
-
امکان تکرار دقیق جلسات درمانی
-
افزایش ایمنی و استانداردسازی درمان
جمعبندی:
درمان مؤثر با rTMS نیازمند درک عمیق از تفاوتهای آناتومیکی بیماران است. استفاده از روشهای تصویربرداری مانند MRI و ابزارهای هدایت عصبی (Neuronavigation) نقشی کلیدی در شخصیسازی محل تحریک دارد و کمک میکند درمان از حالت یکسان برای همه، به پروتکلهای اختصاصی برای هر بیمار ارتقا یابد.
4. تأثیر سن افراد بر تنظیم شدت تحریک
سن افراد یکی از متغیرهای بیولوژیکی مهم در شخصیسازی درمان با rTMS به شمار میرود. تغییرات فیزیولوژیکی و ساختاری ناشی از سن میتوانند بر نحوهی پاسخ مغز به تحریک مغناطیسی تأثیر بگذارند، و لذا تنظیم شدت پالسها باید متناسب با سن و شرایط فردی بیمار انجام شود.
الف) تغییرات سن و هدایتپذیری قشر مغز
با افزایش یا کاهش سن، ویژگیهای الکتروفیزیولوژیکی و ساختاری مغز تغییر میکند:
-
در افراد سالمند، بهدلیل آتروفی قشر مغز و افزایش فاصلهی بین جمجمه و سطح قشر (بهدلیل تحلیل بافتها)، میدان مغناطیسی باید مسیر طولانیتری را برای رسیدن به نورونها طی کند.
-
در مقابل، در نوجوانان، مغز هنوز در حال تکامل است و حساسیت نورونی نسبت به تحریک بیشتر است.
-
این تغییرات میتواند باعث کاهش یا افزایش آستانه تحریک موتور (Motor Threshold) در سنین مختلف شود.

تحریک مغناطیسی مغز-TMS (یافتن MT)
بنابراین، شدت استاندارد که در بزرگسالان استفاده میشود، ممکن است برای گروههای سنی دیگر مناسب نباشد و نیاز به تنظیمات اختصاصی داشته باشد.
ب) تنظیم شدت پالسها بر اساس سن و ویژگیهای فیزیولوژیکی
در پروتکلهای استاندارد rTMS، شدت تحریک معمولاً به صورت درصدی از Motor Threshold فردی (مثلاً 110٪ RMT) تعیین میشود. اما این آستانه بهطور مستقیم با سن بیمار ارتباط دارد:
-
در سالمندان، معمولاً RMT بالاتر است (نیاز به شدت بیشتر برای رسیدن به پاسخ حرکتی).
-
در نوجوانان و جوانترها، RMT پایینتر است، و شدت تحریک باید با احتیاط کاهش یابد تا از عوارض جانبی مانند سردرد یا تحریک بیشازحد پیشگیری شود.
در شخصیسازی درمان با rTMS، لازم است شدت پالسها نهتنها بر اساس RMT، بلکه با در نظر گرفتن سن بیولوژیکی، شرایط سلامت عمومی، و داروهای مصرفی تنظیم شود.
ج) ملاحظات ویژه برای سالمندان و نوجوانان
✅ در سالمندان:
-
استفاده از شدتهای بالاتر ممکن است نیاز باشد، اما در عین حال باید مراقب افزایش ریسک تشنج یا ناراحتیهای عضلانی بود.
-
به دلیل تغییرات در ساختار مغز، ممکن است نیاز به استفاده از کویلهایی با عمق نفوذ بیشتر (مانند H-coil) وجود داشته باشد.
✅ در نوجوانان:
-
مغز در دورهی حساسی از رشد قرار دارد؛ لذا شدت تحریک باید با دقت بیشتری تنظیم گردد.
-
برخی دستورالعملهای بالینی استفاده از rTMS در نوجوانان را تنها در موارد مقاوم به درمان مجاز میدانند و با نظارت تخصصی کامل انجام میشود.
-
انتخاب فرکانس، تعداد جلسات، و محل تحریک باید با رویکردی شخصیسازیشده و محافظهکارانه همراه باشد.
نتیجهگیری:
شخصیسازی درمان با rTMS مستلزم در نظر گرفتن متغیرهای فردی از جمله سن است. با توجه به تفاوتهای سنی در هدایتپذیری قشر مغز، آستانه تحریک و پاسخپذیری نورونی، باید شدت پالسها بهگونهای تنظیم شود که هم مؤثر باشد و هم ایمن. این امر نقش کلیدی در افزایش موفقیت درمانی، کاهش عوارض جانبی، و تطبیق پروتکلها با نیازهای خاص هر بیمار ایفا میکند.
5. استفاده از نقشههای مغزی (qEEG) برای شخصیسازی پروتکل TMS
در سالهای اخیر، بهرهگیری از نقشهبرداری کمی EEG یا qEEG (quantitative EEG) در طراحی پروتکلهای شخصیسازیشدهی TMS رشد چشمگیری داشته است. برخلاف رویکردهای سنتی که بر اساس محلهای آناتومیکی استاندارد مانند ناحیهی پیشپیشانی چپ (DLPFC) صورت میگیرند، qEEG امکان تحلیل دقیق و اختصاصی فعالیت الکتریکی مغز را فراهم میکند تا درمان بر اساس الگوی عملکردی واقعی مغز هر فرد تنظیم شود.
الف) تحلیل نقشههای EEG برای شناسایی نواحی هدف
qEEG با پردازش دادههای خام EEG و تبدیل آن به نقشههای رنگی، نمایی از قدرت نسبی یا مطلق باندهای فرکانسی مختلف (دلتا، تتا، آلفا، بتا، گاما) در نواحی گوناگون مغز ارائه میدهد. این نقشهها به متخصص امکان میدهد:
-
تشخیص نواحی با فعالیت غیرنرمال در قشر مغز
-
شناسایی نواحی hypoactive یا hyperactive
-
مقایسه الگوهای فردی با بانکهای دادهی نوروتیپیکال (normative database)
برای مثال، در افراد مبتلا به افسردگی، گاهی کاهش فعالیت آلفا در DLPFC چپ یا افزایش فعالیت تتا در ناحیه فرونتال میانی مشاهده میشود. این اطلاعات پایهی طراحی پروتکل هدفمند و شخصیسازیشده خواهد بود.
ب) بررسی الگوهای بیشفعالی یا کاهش فعالیت در نواحی مغزی
یکی از اهداف اصلی در شخصیسازی درمان با rTMS، تنظیم جهت تحریک بر اساس عملکرد نوروفیزیولوژیکی واقعی است. بهصورت کلی:
-
اگر ناحیهای کاهش فعالیت (hypoactivity) نشان دهد، از تحریک تسهیلکننده (مثلاً فرکانس بالا یا iTBS) استفاده میشود.
-
اگر ناحیهای بیشفعالی (hyperactivity) نشان دهد، از تحریک مهاری (مثلاً فرکانس پایین یا cTBS) بهره گرفته میشود.
برای مثال:
-
در اضطراب فراگیر (GAD)، افزایش فعالیت باند بتا در ناحیه F4 ممکن است با تحریک مهاری 1Hz هدف قرار گیرد.
-
در ADHD، کاهش آلفا در ناحیه مرکزی میتواند نیازمند تحریک افزایشدهنده باشد.
این تنظیمات بر پایهی qEEG و نه صرفاً مکانیابی آناتومیکی تعیین میشوند، که گام مهمی در تحقق کامل شخصیسازی درمان با rTMS است.
ج) طراحی پروتکل بر اساس یافتههای نوروفیزیولوژیکی فردی
اطلاعات استخراجشده از qEEG به طراحی یک پروتکل کاملاً فردی با رویکرد شخصیسازی درمان با rTMS منجر میشود که شامل موارد زیر است:
-
تعیین دقیق ناحیهی هدف (Target Site): بهجای استفاده از DLPFC بهطور پیشفرض، ممکن است نواحی دیگر مانند SMA، vmPFC یا ACC نیز در اولویت قرار گیرند.
-
انتخاب فرکانس تحریک (1Hz، 10Hz، iTBS، cTBS): متناسب با الگوی مغزی خاص هر فرد.
-
تعداد جلسات و مدت زمان تحریک: بر اساس شدت اختلال در نقشه مغزی.
-
ترکیب چند ناحیه در یک پروتکل: مثلاً تحریک مهاری یک ناحیه و تحریک افزایشی ناحیهی دیگر در یک برنامهی درمانی ترکیبی.
برخی کلینیکهای پیشرو از نرمافزارهای اختصاصی مانند Neuroguide، BrainAvatar یا Loreta Z-score Neurofeedback برای استخراج نقشهها و طراحی پروتکل استفاده میکنند.
نتیجهگیری:
شخصیسازی درمان با rTMS بر پایهی qEEG رویکردی انقلابی در درمان اختلالات روانپزشکی و نورولوژیکی فراهم میسازد. با تحلیل دقیق نقشههای مغزی، میتوان نواحی آسیبدیده یا بیشفعال را بهطور اختصاصی هدف قرار داد و از پروتکلهایی با حداکثر اثربخشی و حداقل عوارض استفاده کرد. این روش، درمان rTMS را از یک مداخله عمومی به یک درمان دقیق و مبتنی بر مغز هر فرد تبدیل میکند.
6. پروتکلهای شخصیسازیشده تتا برست (Theta Burst Stimulation)
تحریک تتا برست مغناطیسی (TBS) نوعی پیشرفته از rTMS است که با الگوبرداری از الگوهای نوسانی طبیعی مغز در باند تتا (5 Hz) طراحی شده است. این تکنیک، به دلیل زمان کوتاهتر و اثربخشی مشابه یا حتی بیشتر نسبت به rTMS کلاسیک، در سالهای اخیر به عنوان گزینهای کارآمد و شخصیسازیپذیر در درمان اختلالات روانپزشکی مطرح شده است.
۱. تفاوت بین iTBS و cTBS
پروتکلهای TBS به دو نوع اصلی تقسیم میشوند:
| نوع پروتکل | نوع اثر | کاربرد اصلی |
|---|---|---|
| iTBS (intermittent TBS) | افزایشدهنده فعالیت نورونی (تسهیلی) | درمان افسردگی، تقویت کارکرد شناختی |
| cTBS (continuous TBS) | کاهنده فعالیت نورونی (مهاری) | درمان اضطراب، وسواس، بیشفعالی یا افزایش فعالیت قشری غیرطبیعی |
-
iTBS: بهصورت دورههای کوتاه تحریک با وقفه انجام میشود (2s تحریک + 8s استراحت، مجموعاً در 3 دقیقه).
-
cTBS: بهصورت مداوم در طی 40 ثانیه اجرا میشود.
در پروتکلهای شخصیسازیشده TBS، انتخاب بین iTBS یا cTBS بر اساس یافتههای qEEG، علائم بالینی، و پاسخ اولیه بیمار انجام میشود.
۲. مزایای تتا برست در کاهش زمان درمان
TBS به طور چشمگیری مدت زمان جلسات درمانی را کاهش میدهد:
-
جلسات iTBS معمولاً در حدود ۳ تا ۵ دقیقه زمان میبرند، در حالیکه rTMS کلاسیک ممکن است ۲۰ تا ۴۰ دقیقه به طول بینجامد.
-
این کاهش زمان نهتنها موجب افزایش راحتی بیمار و بهبود پذیرش درمان میشود، بلکه امکان اجرای جلسات چندگانه در روز (Accelerated TMS) را نیز فراهم میسازد.
از منظر شخصیسازی، کوتاه بودن پروتکل TBS این امکان را میدهد که در طول درمان، پارامترها بهسرعت بر اساس پاسخ مغزی بیمار اصلاح شوند.
۳. تنظیم پارامترها بر اساس پاسخ مغزی و بالینی بیمار
برای اجرای مؤثر پروتکلهای شخصیسازیشده TBS، باید به موارد زیر توجه شود:
الف) تعیین محل تحریک:
-
بر اساس دادههای qEEG یا fMRI، میتوان نواحی دارای اختلال عملکرد را شناسایی کرد.
-
در افسردگی مقاوم به درمان: iTBS بر DLPFC چپ
-
در اختلال وسواس (OCD): cTBS بر SMA یا DLPFC راست
ب) تعیین نوع و شدت تحریک:
-
انتخاب بین iTBS یا cTBS باید بر اساس نوع اختلال، شدت علائم، و وضعیت الکتروفیزیولوژیکی مغز باشد.
-
شدت پالسها معمولاً بر حسب درصدی از RMT تنظیم میشود (معمولاً 80٪ RMT)، اما در پروتکلهای پیشرفته، ممکن است بر اساس پاسخهای فردی تنظیم گردد.
ج) ارزیابی پاسخ درمانی و اصلاح پروتکل:
-
با بررسی تغییرات در نقشههای qEEG قبل و بعد از جلسات یا پاسخ بالینی با ابزارهایی مانند BDI یا HAM-D، میتوان پروتکل را اصلاح کرد.
-
در صورت عدم پاسخ: افزایش تعداد پالسها، افزایش تعداد جلسات در هفته، یا تغییر ناحیه هدف میتواند مؤثر باشد.
د) ترکیب TBS با سایر روشها:
-
در برخی موارد، TBS با نوروفیدبک یا رواندرمانی شناختی ترکیب میشود تا اثرات درمانی بهینهتری حاصل گردد.
-
همچنین، در بیماران مقاوم، از TBS دو ناحیهای (مانند iTBS بر DLPFC چپ و cTBS بر DLPFC راست) استفاده میشود.
نتیجهگیری:
پروتکلهای شخصیسازیشده تتا برست، با زمان درمان بسیار کوتاهتر، قابلیت تنظیم دقیقتر، و اثربخشی بالاتر، ابزار قدرتمندی برای مداخلات مغزی هدفمند در بیماران با نیازهای متفاوت هستند. این تکنولوژی نوین، در ترکیب با دادههای qEEG و ارزیابیهای دقیق بالینی، میتواند نقش مهمی در توسعه نسل جدید درمانهای مبتنی بر مغز ایفا کند.
7. تعیین تعداد جلسات درمانی TMS بر اساس پاسخ فردی
(در چارچوب پروتکلهای شخصیسازیشده TMS)
یکی از ارکان کلیدی در موفقیت درمان با rTMS، تعداد جلسات درمانی و الگوی زمانبندی آنهاست. برخلاف رویکردهای کلاسیک که معمولاً تعداد ثابتی از جلسات را برای همه بیماران تجویز میکنند (مثلاً 20 یا 30 جلسه)، در رویکرد شخصیسازیشده تلاش میشود تعداد، فرکانس و حتی محل تحریک بر اساس پاسخ فردی، شاخصهای نوروفیزیولوژیکی و پیشرفت بالینی تنظیم گردد.
۱. پروتکلهای استاندارد و متغیر
در پروتکلهای کلاسیک استاندارد (مثلاً برای افسردگی)، معمولاً:
-
5 جلسه در هفته به مدت 4 تا 6 هفته تجویز میشود (جمعاً 20 تا 30 جلسه)
-
شدت تحریک: 120٪ RMT
-
هدف: DLPFC چپ (برای MDD)
اما در پروتکلهای شخصیسازیشده، تعداد جلسات میتواند افزایش یا کاهش یابد، بسته به مواردی چون:
-
شدت اولیه علائم (مثلاً نمره BDI یا HAM-D)
-
تغییرات در qEEG پس از جلسات اولیه
-
مقاومت به درمانهای پیشین
-
ویژگیهای فردی (سن، داروهای همزمان، بیماریهای همراه)
برای مثال، در بیماران مقاوم، تا 40 یا حتی 50 جلسه درمانی با تنظیمات تدریجی ممکن است لازم باشد، در حالیکه بیماران با پاسخ سریع، ممکن است پس از 15 تا 18 جلسه بهبود کامل نشان دهند.
۲. پایش پیشرفت بالینی و تنظیم تعداد جلسات
یکی از مزایای کلیدی درمان شخصیسازیشده با TMS، پایش مداوم پاسخ درمانی و امکان تصمیمگیری لحظهای درباره ادامه یا توقف درمان است. ابزارهای پایش شامل:
-
پرسشنامههای بالینی (BDI-II، HAM-D، GAD-7، Y-BOCS و …)
-
qEEG های دورهای برای بررسی تغییرات فعالیت مغزی
-
گزارشهای فردی از بهبود عملکرد روزانه یا کاهش علائم
در صورت مشاهدهی روند پیشرفت آهسته یا توقف پاسخ:
-
میتوان فرکانس جلسات را افزایش داد (مثلاً جلسات دوبار در روز یا 6 جلسه در هفته)
-
یا با استفاده از پروتکلهای تسریعشده (Accelerated TMS) تعداد جلسات را در بازهی کوتاهتری فشرده کرد (مثلاً 10 جلسه در 5 روز)
در برخی موارد نیز، اگر پاسخ ضعیف باشد، میتوان ناحیهی تحریک را تغییر داد (مثلاً از DLPFC چپ به vmPFC یا ACC) یا نوع تحریک را عوض کرد (مثلاً از 10Hz به iTBS).
۳. مفهوم «Maintenance Sessions» در جلوگیری از عود
یکی از چالشهای مهم پس از اتمام دورهی اولیهی درمان، پیشگیری از عود علائم است. در رویکرد کلاسیک، این موضوع کمتر مورد توجه قرار میگیرد، اما در درمان شخصیسازیشده با rTMS، بخش مهمی از برنامهی درمانی را تشکیل میدهد.
جلسات نگهدارنده (Maintenance Sessions):
-
جلساتی هستند که پس از پایان دورهی اصلی درمان، بهصورت هفتگی، دو هفته یکبار یا ماهیانه انجام میشوند.
-
هدف آنها حفظ اثرات درمانی بلندمدت و جلوگیری از عود علائم است.
-
در بیمارانی که سابقهی عود مکرر دارند یا به درمانهای دیگر پاسخ نمیدهند، جلسات نگهدارنده میتوانند نقشی حیاتی ایفا کنند.
پایش qEEG در این مرحله نیز کمک میکند تا در صورت بازگشت تدریجی اختلالات مغزی عملکردی، پیش از ظهور علائم رفتاری، مداخله شود.
نتیجهگیری:
درمان موفق با rTMS، بهویژه در قالب پروتکلهای شخصیسازیشده، به معنای پایبندی انعطافپذیر به پاسخهای فردی است. تعیین تعداد جلسات نهتنها باید بر اساس دستورالعملهای استاندارد، بلکه بر مبنای دادههای عینی از پاسخ بالینی، EEG و نیازهای خاص هر بیمار صورت گیرد. همچنین، طراحی جلسات نگهدارنده بهمنظور افزایش پایداری نتایج درمان، یکی از راهبردهای اساسی در جلوگیری از عود و افزایش طول عمر درمان است.
8. انتخاب فرکانس مناسب برای درمان
(نقش فرکانس در شخصیسازی درمان با rTMS)
یکی از مهمترین پارامترهایی که در طراحی پروتکل rTMS باید در نظر گرفته شود، فرکانس تحریک مغناطیسی است. فرکانس، به تعداد پالسهای مغناطیسی در هر ثانیه (Hz) اشاره دارد و نقش مستقیمی در نوع پاسخ نوروفیزیولوژیک مغز ایفا میکند. انتخاب صحیح فرکانس، میتواند اثربخشی درمان را افزایش داده و از بروز عوارض جانبی جلوگیری کند.
۱. فرکانسهای بالا (≥10Hz) در مقابل فرکانسهای پایین (≤1Hz)
-
تحریک با فرکانس بالا (High-frequency rTMS):
-
معمولاً شامل 10 تا 20 هرتز است.
-
باعث افزایش فعالیت نورونی و تحریک ناحیه هدف میشود.
-
عمدتاً برای اختلالاتی مانند افسردگی (تحریک DLPFC چپ)، ADHD و بعضی از موارد PTSD کاربرد دارد.
-
مکانیسم: افزایش پتانسیل طولانیمدت (LTP-like effects) در سیناپسهای مغزی.
-
-
تحریک با فرکانس پایین (Low-frequency rTMS):
-
معمولاً 1Hz یا کمتر.
-
منجر به کاهش فعالیت نورونی در ناحیهی هدف میشود (مهار فعالیت).
-
مناسب برای اختلالاتی مانند:
-
افسردگی با اضطراب بالا (مهار DLPFC راست)
-
PTSD
-
وسواس فکری-عملی (OCD)
-
تشنج و صرع
-
-
مکانیسم: تقویت مهار نورونی از طریق اثرات شبیه به LTD (Long-term depression)
-
۲. انتخاب بر اساس نوع اختلال روانپزشکی یا نورولوژیکی
پروتکلهای فرکانسی باید متناسب با نوع اختلال، نیمکرهی مغزی درگیر، و مکانیسم پاتوفیزیولوژیک بیماری انتخاب شوند. به طور خلاصه:
| اختلال | ناحیه هدف | فرکانس معمول |
|---|---|---|
| افسردگی (MDD) | DLPFC چپ | 10–20 Hz |
| افسردگی مقاوم | DLPFC چپ + راست | 10Hz + 1Hz |
| اضطراب | DLPFC راست | 1Hz |
| PTSD | vmPFC یا DLPFC راست | 1Hz یا iTBS |
| OCD | SMA یا DLPFC | 1Hz یا H-coil |
| اسکیزوفرنی (توهم شنیداری) | شیار گیجگاهی فوقانی چپ (STG) | 1Hz |
| درد مزمن | M1 یا DLPFC | 10Hz یا iTBS |
| اعتیاد | vmPFC یا DLPFC | 10Hz یا 1Hz |
نکته مهم در شخصیسازی این است که در برخی بیماران، پاسخ بالینی مطلوب ممکن است با فرکانسی متفاوت از پروتکل کلاسیک حاصل شود. به همین دلیل، بسیاری از مراکز بالینی پیشرفته، پس از بررسی الگوهای EEG، فرکانس را بر اساس الگوی بیشفعالی یا مهاری در نواحی مختلف مغز تعیین میکنند.
۳. بررسی پاسخپذیری به تحریک بر اساس فرکانسهای مختلف
پاسخ به rTMS، نهتنها به محل و شدت، بلکه به فرکانس تحریک نیز بستگی دارد. برخی افراد ممکن است به فرکانسهای بالا بهتر پاسخ دهند و برخی به فرکانسهای پایین. عوامل مؤثر شامل:
-
ویژگیهای نوروفیزیولوژیکی فرد (بر اساس qEEG):
-
اگر فعالیت موج آلفا در DLPFC چپ پایین باشد، تحریک با فرکانس بالا مؤثرتر خواهد بود.
-
اگر در DLPFC راست بیشفعالی دیده شود، فرکانس پایین برای مهار آن مناسبتر است.
-
-
سن و پلاستیسیته مغزی:
-
در سالمندان، مغز ممکن است به فرکانسهای پایین پاسخ بهتری دهد، به دلیل کاهش انعطافپذیری سیناپسی.
-
-
پاسخ قبلی به درمان:
-
در صورت عدم پاسخ به 10Hz، میتوان فرکانس را کاهش داد یا به iTBS تغییر داد.
-
-
عوارض جانبی:
-
در صورت بروز تحریکپذیری بیش از حد یا سردردهای مکرر، ممکن است نیاز به تغییر فرکانس یا کاهش آن وجود داشته باشد.
-
نتیجهگیری:
انتخاب فرکانس در rTMS باید بهصورت دینامیک و مبتنی بر ارزیابی دقیق فردی انجام گیرد. استفاده از دادههای EEG، علائم بالینی و سابقهی درمان، بهویژه در پروتکلهای شخصیسازیشده rTMS، نقش کلیدی در تعیین فرکانس مؤثر ایفا میکند. بدین ترتیب، درمان از یک رویکرد «یکسان برای همه» به یک رویکرد هدفمند و تطبیقی تبدیل میشود.
9. یافتن آستانه تحریک حرکتی (Motor Threshold) و نقش آن در درمان
یکی از پایهایترین مراحل پیش از شروع جلسات درمان با rTMS، تعیین آستانه تحریک حرکتی (Motor Threshold – MT) است. آستانه تحریک، به کمترین شدت پالس مغناطیسی گفته میشود که باعث انقباض قابل مشاهده یا ثبتشدهی عضله (معمولاً عضله ابداکتور انگشت شست) در پاسخ به تحریک قشر حرکتی میشود. این مقدار بهصورت شخصی برای هر بیمار محاسبه شده و مبنایی برای تنظیم شدت پالسها در طول درمان فراهم میکند.
1. روشهای تعیین آستانه تحریک حرکتی (RMT / AMT)
آستانه تحریک حرکتی به دو شکل اصلی تعریف و اندازهگیری میشود:
-
RMT (Resting Motor Threshold):
-
به حداقل شدت تحریک گفته میشود که در شرایط استراحت عضله، حداقل ۵ پاسخ عضلانی قابل مشاهده یا ثبتشده در ۱۰ تحریک متوالی ایجاد شود.
-
این روش بیشتر در شرایط بالینی و برای بیماران با فعالیت عضلانی پایین کاربرد دارد.
-
ابزار: EMG، مشاهده چشمی، یا حسگرهای حرکتی.
-
-
AMT (Active Motor Threshold):
-
در حالیکه عضله مورد نظر کمی فعال و در حالت انقباض ضعیف باشد، حداقل شدت لازم برای تولید ۵ پاسخ مشخص در ۱۰ تحریک تعیین میشود.
-
بیشتر در شرایط تحقیقاتی و مطالعات شناختی بهکار میرود.
-
حساستر است ولی ممکن است در افراد با همکاری ضعیف یا مشکلات حرکتی دشوار باشد.
-
روش استاندارد شامل استفاده از کویل شکل ۸ روی قشر حرکتی اولیه (M1) در نیمکره غالب، و ثبت پاسخ عضله با کمک EMG یا مشاهده حرکت انگشت است.
2. کاربرد آستانه در تنظیم شدت تحریک در جلسات درمانی
میزان شدت تحریک در پروتکلهای rTMS بهصورت درصدی از آستانه تحریک حرکتی (مثلاً «110% RMT») تنظیم میشود. بهعبارتی، تعیین دقیق آستانه تحریک کمک میکند تا:
-
شدت پالسها برای هر فرد بهصورت شخصی تنظیم شود.
-
از تحریک بیش از حد یا ناکافی جلوگیری گردد.
-
ایمنی بیمار تضمین شود و خطر تشنج کاهش یابد.
-
پاسخ درمانی بهینهتری حاصل شود.
برای مثال، پروتکل کلاسیک درمان افسردگی معمولاً از 120% RMT استفاده میکند، در حالی که برخی پروتکلهای تتابرست (iTBS) با 80% RMT اجرا میشوند.
3. رابطه بین آستانه تحریک و پاسخ درمانی
تحقیقات نشان دادهاند که آستانه تحریک میتواند نشانگر خوبی برای وضعیت کلی تحریکپذیری قشر مغز و پتانسیل پاسخ به درمان باشد:
-
افراد با آستانه پایینتر (یعنی نیاز به شدت تحریک کمتر برای ایجاد پاسخ):
-
معمولاً تحریکپذیری نورونی بالاتری دارند.
-
ممکن است به شدت پایینتری از rTMS نیز پاسخ مناسب بدهند.
-
-
افراد با آستانه بالاتر:
-
گاهی با کاهش پلاستیسیته یا انسجام شبکههای مغزی همراهاند (بهویژه در سالمندان یا بیماران نورولوژیک).
-
ممکن است نیاز به تنظیم شدت بالاتر یا استفاده از کویلهای عمیقتر (مثل H-coil) داشته باشند.
-
-
شخصیسازی شدت تحریک بر اساس آستانه فردی میتواند منجر به بهبود پاسخپذیری، کاهش عوارض جانبی و افزایش کارایی درمان شود.
همچنین برخی مطالعات پیشنهاد دادهاند که پایش تغییرات آستانه تحریک در طول دوره درمان میتواند بهعنوان شاخصی برای ارزیابی اثربخشی مداخلات و نیاز به تنظیم پروتکل مورد استفاده قرار گیرد.
جمعبندی:
آستانه تحریک حرکتی یکی از مؤلفههای اساسی در شخصیسازی درمان با rTMS است. با تعیین دقیق RMT یا AMT و تنظیم شدت پالسها بر مبنای آن، میتوان اثربخشی درمان را بهحداکثر رساند و از خطرات احتمالی جلوگیری کرد. این موضوع، بهویژه در بیماران سالمند، کودکان، یا کسانی با ساختارهای آناتومیکی خاص، اهمیت بیشتری پیدا میکند.